Salt - химическа енциклопедия
СОЛ. клас химически. съединения. Общоприето определение на "соли", както и термините "киселинни и базови", продукти на взаимодействие. до ryh сол в момента не съществува. Солите могат да се разглеждат като заместване продукти от водородни протони до-ви за метални йони и други катиони или ОН групи на базата на анионите-тон (например Cl - ,.) .. Заместващите продукти от пълноценна среда са соли, напр. Na 2SO 4. MgCl2. непълна - киселинна или основна сол, напр. KHSO4. CuClOH. Разлика е проста сол, съдържащ един вид катион и един вид на аниони (напр. Натриев хлорид), двойна сол, съдържаща два вида катиони [напр. Kal (SO4) 2 · 12H2 О], смесени соли в състава, за да образуват остатъци две ryh киселина (напр. AgClBr). Комплексни соли (вж. Съединението от координация) съдържат комплексни йони. напр. К4 [Fe (CN) 6]. Т. обади. вътрешни соли, напр. Бетаин (CH3) 3 NCH2 СОО -. са биполярни йони.
Типични соли -kristallich. Острови в структурата на йон, напр. CsF (вж. Йонната връзка. Йонни кристали). Има и ковалентни соли, напр. A1Sl3 (вж. Ковалентни кристали). В действителност, същността на химичното вещество. Комуникация между много соли - Смесени. На правила образуват соли имена се отнасят. Химична номенклатура.
За р-rimosti разграничи разтворими във вода, умерено разтворими и по същество е неразтворим соли. Към р - разтворим включва почти всички от натриева сол. калий и амоний. пл. нитрати. ацетати и хлориди. освен поливалентни метални соли. хидролиза във вода. пл. киселина сол.
Във воден р-ма сол напълно или частично дисоциират на йони (вж. Електролитна дисоциация). Соли на слаби до т, и (или) се подлагат на слабите бази с хидролиза. Вода соли на р-RY съдържат хидратирани. йони (вж. хидратация), йонни двойки и по-сложни химически. форми, включително хидролизни продукти и др. Редица соли зол. и в алкохоли. ацетон. амиди к-т и сътр. Org. р-celeration.
От воден разтвор на сол на р-ров може да кристализира в кристална форма (вж. Хидрати) на неводна-кристални солвати. напр. SaVr2 H5 OH · 3C2 (вж. Солвати). P-Ry соли взаимодействия. с метали. Стандартни електродни потенциали до-ryh повече отрицателно от потенциала на метала. е част от солта:
Тъй като р-добре разтворими соли на слаби до силни над-трет-да измести слабите:
Тъй като р-добре разтворими соли на слаби основи силна р-разтворим в база изместват слаби:
В водни системи, може да се получи солта между соли обмен р-нето, обработва слабо разтворими соли или комплекси на:
Данните Август. процеси, протичащи в системи за водно-солеви р-rimosti соли при съвместната си присъствие, в зависимост от m-тура, налягане и концентрация. състава на твърди и течни фази, т. б. получен чрез изучаване на диаграмите rimosti р-вода-сол системи (Фигура 1, 2,., виж също анализ разтвори Физикохимични ..).
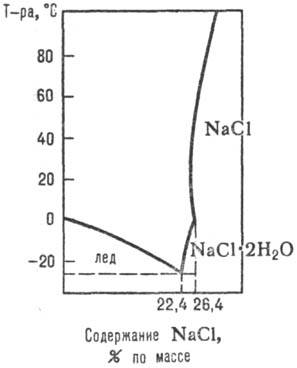
Фиг. 1. Диаграма р-rimosti системи NaCl-Н2 О.
Общи методи за синтез на соли. Взаимодействие. к-т и основа (р-ТА на неутрализация Ур-1.) и към тон на основни оксиди (2) и основи с киселинен оксид (3) или на киселинни и основни оксиди (4):
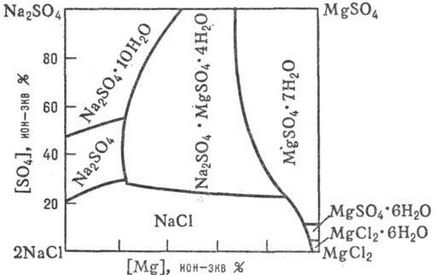
Фиг. Фигура 2. р-rimosti система "море" 2NaCl + MgSO 4 MgCl2 + Na 2SO 4 във вода при 25 ° С
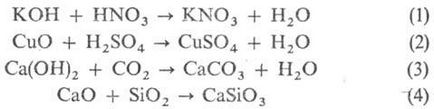
Трябва да се отбележи, че продуктите на взаимодействие. основи и да Люис-тон (cm. киселини и основи) се различават от обичайните соли по отношение на тях се използва препратки. "Киселина-база комплекс" или "адукт". Взаимодействието обмен. между к-тия и сол или основа сол от него и (5.6):
Суровината за бала. получаване на номер на хлоридни соли, сулфати. карбонати. борати Na, К, Са, Mg са морски и океански. вода. при р. саламури, образува, когато тя се изпарява. и твърди отлагания на соли (вж. Galurgiya). За групата на минерали. формиране на депозитите сол утаечни (сулфати и хлориди на Na, К и Mg), условни заглавия приложимо. "Естествен сол." Naib. Големи находища на калиеви соли са намерени в България (Соликамск), Канада и Германия, силен депозити фосфатна руда, в Северна Африка, България и Казахстан, NaNO3 -B Чили.
Соли използвани pishch. Chem. металургични. стъкло, кожа, текстил абитуриентски-STI, в секунди. х-положителни, лекарства и др. г.
Литература Posin М. Е. Технология на минерални соли, 4-то издание. 1 -2 часа, L. 1974 .; Batsanov SS Експериментални Основи на структурните химия. М. 1986, стр. 195-226; Ksenzenko VI Kononova G. N. теоретична основа на процеси за обработка на суровини halurgy, М. 1982, стр. 11-211. VP Данилов.
