урок 25
Урокът 25 "соли", разбира се, "Химия за манекени" да се научат как да се обадя правилно соли, техния състав и да се научат да правят химически формули соли.

Както е отбелязано в предишните уроци киселини в реакции с метални прост вещество освобождава водород Н2. Освен водород, също образува комплекс вещества: ZnCl2. . MgSO 4, и т.н. Те са представители на често срещани в химията на съединенията класа - (. 102 Фиг) сол.

Тук ще разгледаме състава на соли, научете се да направят своите формули, знаят как да се обадя сол.
Състав соли
Сравнете формула киселини солна киселина и H 2SO 4 гр формули ZnCl2 и FeSO4 соли. Виждаме, че в тези формули са идентични аниони CI (I), и SO4 (II). Но киселинни молекули са свързани с водородните атоми Н и соли дефинирани единици - с Zn и Fe желязо цинк атома. Следователно, тези и други соли могат да се считат за замяна продукти от водородните атоми в молекулите на киселини на метали атома. Вещества като ZnCl2 и FeSO4. принадлежи към класа на соли.
Соли - са комплексни вещества, съставени от метални атоми и киселинни остатъци.
Солите на киселинни остатъци се свързват с металните атоми в съответствие с тяхното валентност. За получаване на химичната формула на сол е необходимо да се знае валентността на металния атом и валентността на киселинната част. По този начин се използва същото правило, както при получаването на съединения с формули двоичен. За соли обикновено е както следва: сумата от всички единици валентност на металните атоми трябва да бъде равна на сумата от всички остатъци единици поливалентните киселина.
Например, формулата на сол, който включва калциев атом и киселинен остатък фосфорна киселина РО4 (III). Калциев показва постоянна валентността, II и валентността на киселинния остатък е РО4 III.

имена на соли
Соли, образувани от атомите на различни метали и различни остатъци. Следователно, съставът на солите на най-разнообразни. Да се научим да им даде правилните имена.
Заглавие соли включват киселинни остатъчни имена и имената на метала в родителен случай. Например, съставът на NaCl сол се нарича "натриев хлорид".
Ако част от формула единица сол метален атом има променлива валентност, той е обозначен с римски цифри в скоби след наименованието си. Така, сол FeCl3 наречени "железен хлорид (III)» и Солта FeCl2 - «железен хлорид (II)».
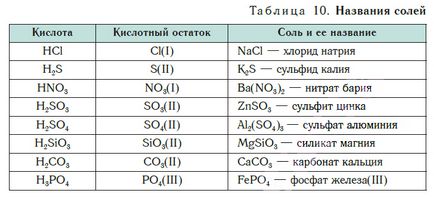
Таблица 10 показва имената на някои соли.
Сол - не-молекулярна структура на материята. Следователно, съставът се експресира като се използва формулата единици. Те отразяват съотношението на метални атоми и киселинни остатъци. Например, в единица формула NaCl на атом Na има един киселинен остатък е хлор.
Според химическата формула на сол може да изчисли формула теглото спрямо н и молекулна маса М. Например:
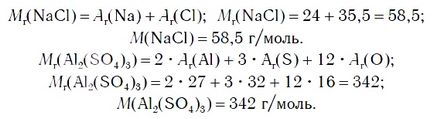
Соли не се отнася само сол (NaCl), но креда, мрамор (СаСО3), натриев карбонат (Na2 CO3), калиев перманганат (KMnO4), и други.
Кратки изводи урок:
- Соли - комплексни вещества, които се състоят от атоми на метали и аниони.
- Солите се получават чрез заместване на водородни атоми в молекулите на киселини на метали атома.
- Сол - не-молекулярна структура на материята.